UT Southwestern 研究人员的一项新研究表明,除了其他影响外,删除小鼠脂肪中的一个关键基因会使整个这些动物的组织产生胰岛素抵抗。最近一期《美国国家科学院院刊》(PNAS)中报道的这一发现可能会阐明 2 型糖尿病和其他胰岛素抵抗疾病,尽管经过数十年的研究,人们对这些疾病仍知之甚少。

2016 年,UTSW 免疫学家和遗传学家 Bruce Beutler 医学博士、Zhao Zhang 博士及其同事报告了一种新的小鼠突变体,他们将其命名为 teeny,这是由于一种称为 KBTBD2 的基因失活而导致的,该基因在小鼠体内广泛表达和人类。除了这些动物体积小——大约是正常“野生型”小鼠的一半——科学家们很快注意到,小老鼠会产生大量尿液,这通常是糖尿病的征兆。
Beutler 是一位摄政教授,也是宿主防御遗传学中心的主任。张是内科助理教授,也在该中心任职。
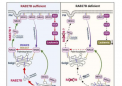
果然,测试表明,这些动物血糖极高,胰岛素抵抗严重,胰岛素水平高,在 8 周龄时达到峰值,然后逐渐下降。他们的体脂含量也异常低,但患有脂肪肝。用正常小鼠的脂肪组织移植小小鼠在很大程度上解决了这些问题,这表明脂肪组织中的 KBTBD2 尤其是其中每一个问题的关键。然而,Beutler 和 Zhang 说,尚不清楚这些问题是否也源于其他胰岛素反应组织(例如肌肉和肝脏)中的 KBTBD2 活性。
为了回答这个问题,研究人员创建了不同的小鼠突变体,其中 KBTBD2 在动物的脂肪、肌肉或肝脏中被选择性地灭活。尽管这些啮齿动物中的每只都长到了正常大小——这表明该基因通过其他途径发挥作用来调节身体生长——但只有那些在脂肪细胞中 KBTBD2 失活的啮齿动物才具有其他一些幼小的标志性特征。这些动物具有极高的胰岛素抵抗,尽管血糖水平只是中等偏高。尽管它们的血液胰岛素水平也很高,但在 8 周大后它们并没有像小老鼠那样下降。
 新传媒网
新传媒网